分享|医疗器械设计开发示例分析
设计开发的定义
设计和开发:将要求转化为产品、过程和体系的规定特性或规范的一组过程。”

产品战略
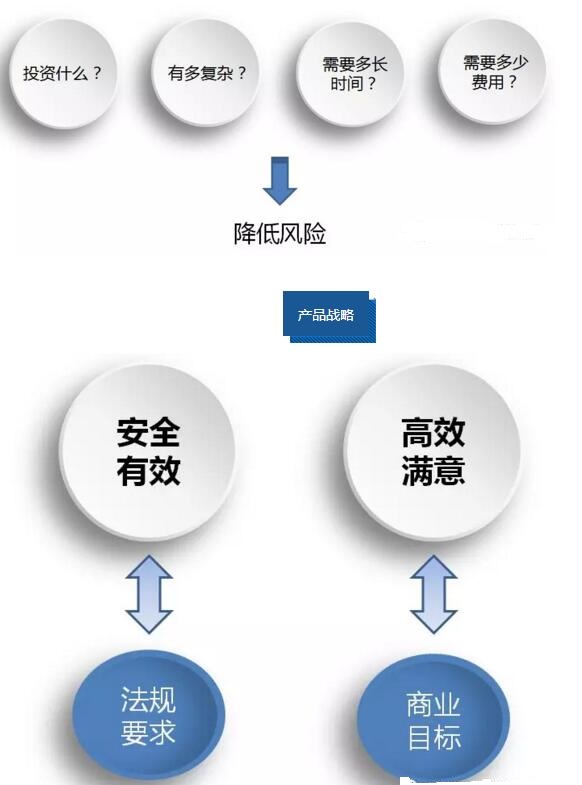
产品战略组成元素
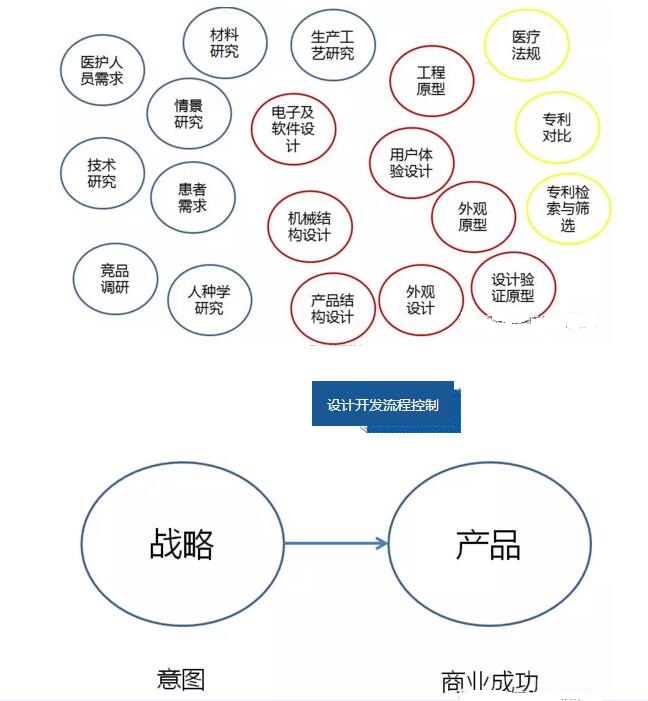
设计开发控制流程
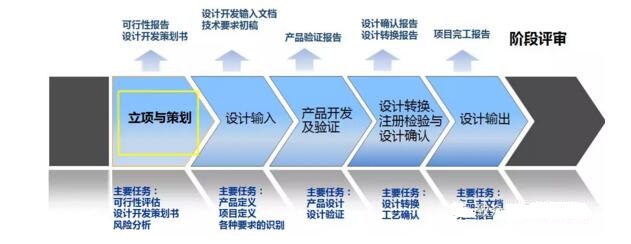
设计开发立项与策划

可行性评估


设计开发任务和策划

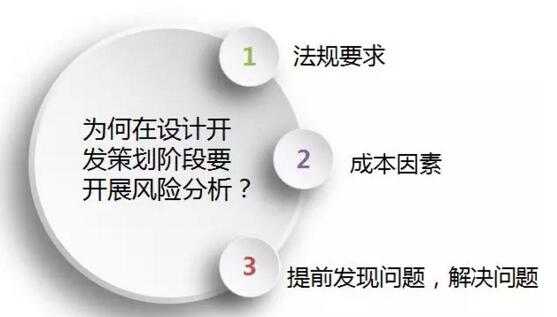
风险分析
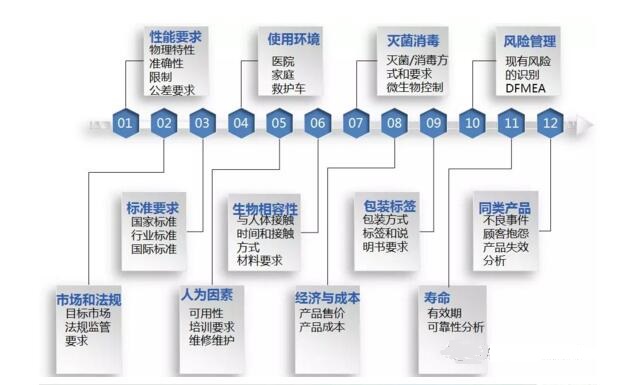
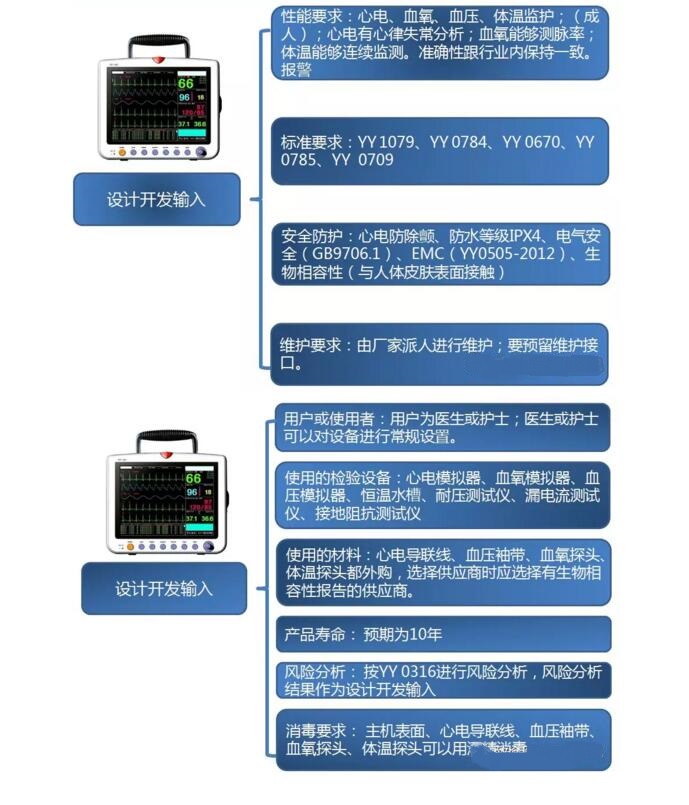
设计开发输入
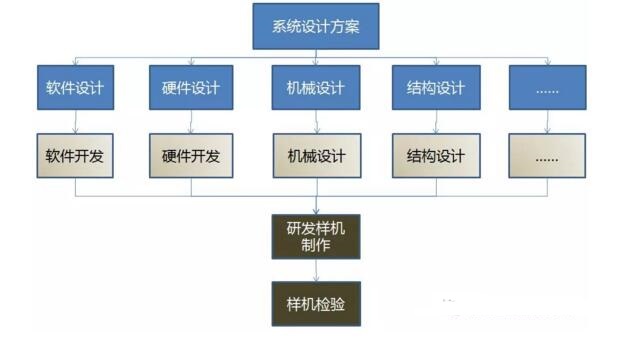
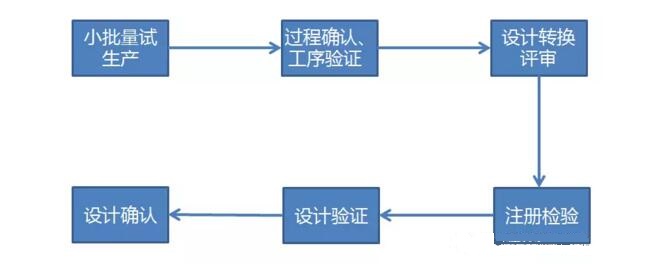
设计转换、注册检验与设计确认
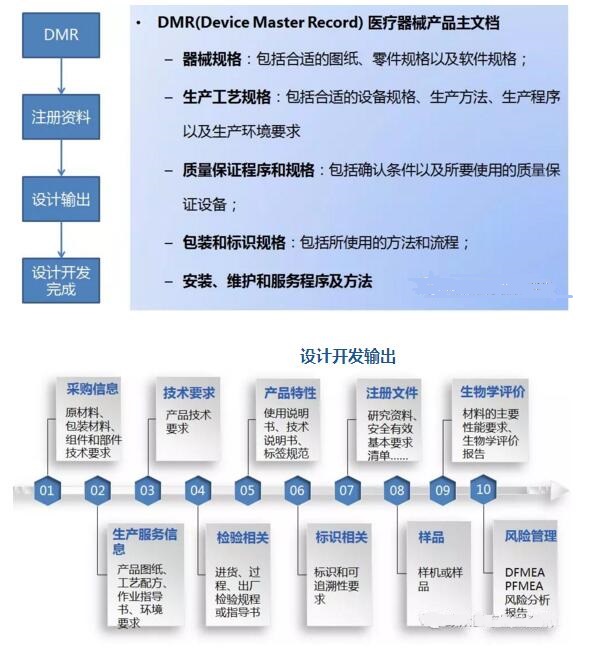
设计输出
各重要环节的要求
设计开发验证
要求
ü应当结合策划的结果,在适宜的阶段进行设计和开发验证,确保设计开发输出满足输入的要求;
ü应当保持设计和开发验证记录、验证结果和任何必要措施的记录;
ü若设计和开发验证采用的是可供选择的计算方法或经证实的设计进行比较的方法,应当评审所用的方法的适宜性,确认方法是否科学和有效。
验证类型
对设计的数据或要求采取不同的方法进行计算和验证;
与类似设计进行比较;
制作样机试验和演示;
对样机进行自检;
请第三方检测;
对文件的评审(有经验的人员或专家对文件进行评审)设计开发验证
验证内容














ü产品验证,如制程中的试验、成品的试验、某项性能的试验
ü产品有效期验证
ü生物相容性验证(如有与人体接触部分)
ü生产特殊工序过程确认
ü包装验证
ü生产设备验证
ü特殊过程验证/确认设计开发确认
确认内容
Ø注册临床评价
ü临床试验:《临床试验方案》、《临床试验伦理批件》、《临床试验协议》、《CRF表》、《知情同意书》、《临床试验报告》
ü免临床文献评估
ü同品种医疗器械临床评价设计转换
设计转换内容
生产设备验证
试生产
过程检验
成品检验
产品有效期验证
生物相容性验证(如有与人体接触部分)
生产过程特殊工序过程确认(焊接工序等)
工艺验证
包装的验证
风险管理
设计和开发转换总结报告设计变更
设计变更内容
ü评审、验证和确认进行的更改
ü事后识别出的,在设计阶段产生的错误(如计算、材料选择);
ü在设计和开发后发现的制造、安装和/或服务中的困难;
ü从工程学上要求的更改;
ü风险管理活动要求的更改;
ü顾客或供方要求的更改;
ü纠正和预防措施所要求的更改;
ü安全性,法规要求或其他要求所需的更改;
ü对产品功能或性能的改进。设计和开发评审
设计评审内容
什么时候做评审,由企业自行根据需要确定,需要在策划时确定,可以增加或减少。
根据评审的目的,确定评审时机、评审方式和参与评审人。
评审记录,不仅指评审报告(输出),还应包括评审输入。
应对设计转换之前的设计输出进行评审,如制造的可行性、灭菌方法的适宜性、包装的适宜性。
最终输出批准前应全面评审,评审设计输出充分性、法规符合性、产品安全性等。
【本文来源: 致众医疗器械资讯】

全部 0条评论