经验分享|韩国医疗器械审批流程
一、医疗器械法规级别
医疗器械在韩国有四大级别的法规:(如下图)
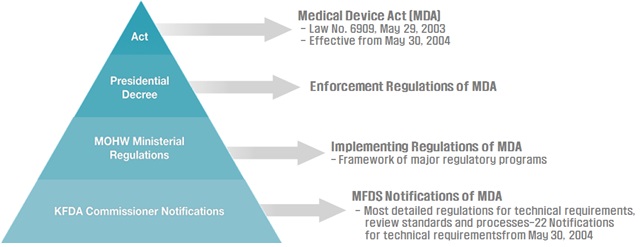
最高级别的是“医疗器械法案”;
第二级别的是“总统令”,这一级别表示的是“医疗器械法案”的执行法规;
第三级别是“韩国卫生福利部法规”,它作为“医疗器械法案”的实施法规;
第四级别是“韩国食药监局局长通告”,它是韩国食品药品安全局对“医疗器械法案”的通告或通知。
二、医疗器械的通告,认证和审批流程
韩国食品药品安全局要求相关单位提交用于医疗器械认证和批准的“技术文件”。
Ⅰ类和Ⅱ类设备需通过“医疗器械信息技术支持中心(MDITAC)”认证,部分Ⅱ类(新型设备)和Ⅲ,Ⅳ类设备需经由韩国食品药品安全局审批。
技术文件
技术文件指有关医疗器械质量(例如功能,安全)的文件,包括原材料,结构,使用目的,使用说明,功能原理,使用注意事项,测试标准等信息。
技术文件的分类
技术文件由申请表和支持文件组成,分为两种不同类型:
(1)通用技术文件审查; 和(2)临床试验审查。
通用技术审查:即将申报的设备如果基本等同于以前批准过的产品,韩国食品药品安全局不要求提供临床研究报告,只要求经过通用技术文件审查。
技术文件审查+安全和效能审查:适用于以下设备:有新研发,新表现,新结构,新用途,并且可能严重改变影响安全性和有效性的设备,此种设备还需要提交临床测试报告。
上市前许可
I类设备:通告
II类设备:认证,审批
III类,IV类设备:审批
医疗器械的分类
基于对人类健康潜在风险的4个等级(Ⅰ〜Ⅳ)
主要用于与全球协调工作组/国际医疗器械监管机构论坛的规则达到一致 - 韩国食品药品安全局中的《医疗器械产品分类法规》中说明了2,219项产品。
上市前审批流程:
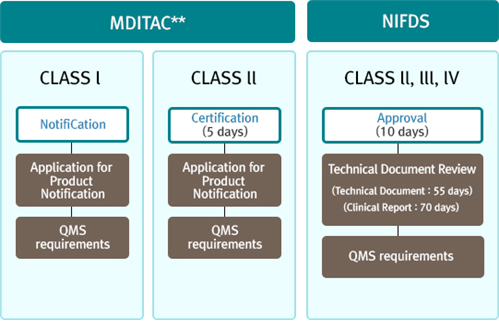
I类:达到质量管理体系要求(QMS)——申请产品通告
II类:达到质量管理体系要求(QMS)——申请产品通告——获得认证
III类:达到质量管理体系要求(QMS)——技术文件审查——审批成功
注意事项:
部分II类设备需要获得审批
由韩国食品药品安全局成立的医疗器械信息技术援助中心(MDITAC)负责与医疗器械认证有关的商业事务,提供有关医疗器械的信息和技术支持,包括提供用于改进医疗器械技术的国际规范研究,分析和海外内的信息。
技术性总结文件的分类
IV类设备(IVD试剂除外)需要提交技术性总结文件(STED)。 - 自2014年1月1日起执行 - 对其他类设备可选
技术性总结文件用于证明医疗器械符合全球协调工作组/国际医疗器械监管机构论坛提出的安全和性能要求,包括设计验证,风险分析和有关安全和性能的制造过程要求。
外部专家参与审查
这些参与高科技、新型医疗器械的咨询和审查的外部专家来自各个领域,共有758名,包括临床,学术,行业内的医学专家。
三、医疗器械营业许可证
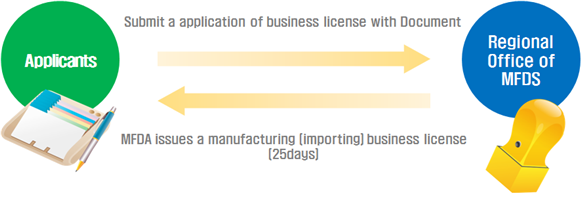
韩国食品药品安全局要求这些打算在韩国生产医疗器械或打算从海外进口医疗器械的企业分别获得生产许可证和进口许可证。
企业营业许可证的批准由韩国食品药品安全局在该企业所在地区的有关区域办事处处理。 由于申请人必须拥有至少一个产品许可证才能获得营业许可证,所以营业许可证和产品许可证的批准程序可以同时进行。
文件要求
由医生出具的证明:证明申请人不是精神病人;或由医疗专家出具的医学证明:证明申请人足以成为制造商的身体条件。
医生出具的医学证明:证明申请人没有毒品成瘾或其他有毒物质的成瘾。
证明质量经理资格的文件。 审核营业执照的批准需要25天,当产品许可证最终获得批准(认证或通告)时,韩国药品食品安全局的地区办事处将颁发营业许可证(生产/进口)(如下图 )。
四、受到跟踪和控制的医疗器械
52种医疗器械被指定为需要跟踪和控制的医疗器械,这些器械需要跟踪,因为当使用这些器械时,如果发生不良事件或发生缺陷,它们可能对人体造成致命伤害。
这52类医疗器械中有48种需要植入人体一年以上,另外4种是生命维持物品,只能用于非医疗机构的场所。
记录的准备,保存和提交
《医疗器械法执行条例》第50条 医疗器械经办人应当按照型号和生产单位准备医疗器械销售记录,用户应当准备记录,以便跟踪使用医疗器械的患者。
(以下表格中的生产商/进口商,经销商,租赁人和检修工都是经办人)
受跟踪和控制的医疗设备
• 48种可植入人体1年以上的器械(以下编号1至48)
• 4种非医疗机构使用的维持生命的物品(49-52号)


【本文来源:艾亿迪商务】

全部 0条评论