医疗器械货架有效期验证分析要点
货架有效期验证是医疗器械产品设计开发过程中重要的一环,该验证的内容决定最终的产品有效期的制定,如何做好器械产品货架有效期验证是至关重要的,接下来我们将从指导原则入手来讲解如何做好医疗器械产品的货架有效期验证。
背景介绍
国家药监局在2022年03月15号发布了:无源植入性医疗器械稳定性研究指导原则(2022年修订版)的通告(2022年第12号);其为2017版本的更新版;2022版本更新的地方有如下几点:
注册审查要点
货架有效期研究
货架有效期影响因素
外部影响因素主要包括:
- 储存条件,例如温度、湿度、光照、通风情况、气压、污染等;
- 运输条件,例如运输过程中的震动、冲撞。
变化内容:原辅材料的影响、生产方式、生产环境、包装、其他影响因素,不再包含在外部影响因素,而是在设计开发过程中考虑的其他影响。
删除2017版中的表述:需要强调的是,并不是所有的医疗器械均需要有一个确定的货架有效期。当某一医疗器械的原材料性能和包装材料性能随时间推移而不会发生显著性改变时,则可能没有必要确定一个严格的货架有效期,而当某一医疗器械的稳定性较差或临床使用风险过高时,其货架有效期则需要进行严格的验证。对于以无菌状态供应的无源植入性医疗器械,注册申请人应指定一个经过验证的确定的货架有效期;
货架有效期验证内容
验证试验类型
医疗器械货架有效期的验证试验通常可分为加速稳定性试验、实时稳定性试验两类。
加速稳定性试验
新增表述:需要注意的是,并不是所有材料/组件的老化均符合阿列纽斯(Arrhenius)反应速率函数的热力学老化特性。注册申请人在使用该函数进行加速稳定性试验设计之前需考虑其适用性。TRT宜能够代表产品实际贮存条件下的温度,可结合预期储存温度范围、已有同类产品历史数据、器械和/或包装材料稳定性数据等设定TRT,并提供制定依据。如产品具有专用的标准或指导文件规定TRT的,宜优先采用。有些产品不适用于上述加速稳定性试验设计的,需要进行实时稳定性试验,如某些药械组合医疗器械产品中的药物成分。
实时稳定性试验
新增表述:申请人可结合预期储存温度范围、已有同类产品历史数据、器械和/或包装材料稳定性数据等设定实时老化温度。如产品具有专用的标准或指导文件规定实时老化温度的,宜优先采用。
其他试验条件的考虑
此节全部新增:
在加速及实时稳定性研究中,申请人宜根据产品特性和预期贮存条件进行评估选择合适的相对湿度,并提供选择的理由和依据。一般建议相对湿度60%±10%。若湿度在有效期内对产品性能影响显著,建议申请人设置高湿度和/或低湿度等条件,对产品进行最不利条件性能验证。若相对湿度在有效期内对产品影响不大,可不对相对湿度进行特殊要求。
如有其他因素显著影响产品的稳定性,建议设定适宜的试验条件进行验证,如光照等。
验证试验测试/评价项目
表述变化:无论加速稳定性试验还是实时稳定性试验,注册申请人均需在试验方案中设定测试项目、测试方法及判定标准。当没有判定标准时,可采用零点时间性能数据作为测试项目的参照指标。测试项目仅需评估产品随时间老化的相关性能,包括器械自身性能测试和包装系统性能测试两方面。其中包装系统性能测试主要目的是为了验证包装系统对微生物的屏障性能,即无菌状态/微生物限度要求的保持。
删除2017版中的表述:如适用,可采用包装封口完整性检测用于替代无菌检测。后者则包括包装完整性、包装强度和微生物屏障性能等检测项目。其中,包装完整性检测项目包括染色液穿透法测定透气包装的密封泄漏试验、目力检测和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。
建议注册申请人在试验过程中设立多个检测时间点(一般不少于3个)对无源植入性医疗器械进行检测。
进行验证试验的产品
表述变化:医疗器械货架有效期验证试验宜采用与常规生产相同的终产品进行,适宜项目(如包装系统性能)可采用无产品或模拟产品的包装进行验证。
注册申请人可对试验产品进行设计最差条件下的验证试验以保证试验产品可代表最恶劣的生产情况,如进行一个标准的灭菌周期后,附加一个或多个灭菌周期,或采用几种不同的灭菌方法。
删除2017版本中:验证的医疗器械建议至少包括三个代表性批次的产品,推荐采用连续三批。
货架有效期研究资料要求
此节内容表述方式改变较多:
(一)注册申请人在无源植入性医疗器械注册时需提供详细的货架有效期研究资料,一般包含试验条件(温度/湿度、运输条件)、测试项目、判定标准、加速老化参数(如适用)、测试时间点、样品型号规格、批次及样本量、测试数据结果及分析、试验结论等。注册申请人若使用其生产的其他医疗器械产品的货架有效期研究资料代替申报产品研究资料,需论证适宜性。
(二)使用稳定性
宜将使用稳定性与货架有效期研究进行区分。产品应在正常使用、维护(如适用)情况下的生命周期内维持其安全性和有效性。植入部位和预期用途不同,影响其使用稳定性的因素也不同,适用时需考虑植入操作的影响。对于无源植入性医疗器械,使用稳定性一般可在性能研究中开展验证。
(三)运输稳定性
运输稳定性通常通过模拟运输试验进行,通过模拟运输过程中环境(温度、湿度、气压等)变化、跌落、碰撞、振动、加速度等,产品不会发生性能、功能改变,包装系统具有保护产品的能力。经过模拟试验后,观察包装外观是否有不可接受的异常现象,测试产品性能功能是否符合要求,证明运输过程中的环境条件不会对医疗器械的特性和性能(包括完整性和清洁度)造成不利影响。对于含液体的医疗器械,还需考虑低温或冻融情况。
运输过程可能影响货架有效期。如影响,模拟运输可与货架有效期合并进行。模拟运输可在老化前或老化后进行。在老化前还是在老化后进行,取决于是模拟先运输至医院储存、还是模拟在生产商处储存然后运输两种不同的情况。
货架有效期要点分析
货架有效期的研究通常涉及两个主要方面的内容:一是产品性能随时间推移的变化情况,二是包装材料对产品无菌状态的影响;在性能研究中,我们会考察产品随着时间的推移是否会出现性能衰退,这并不是说出现产品性能衰退就不可接受,需要具体分析,如果这种性能退化是在可接受范围内,并且满足临床使用和公司内部质量控制的要求,那么该产品的货架有效期即可得到确认并有效。
总的来说,货架有效期是确保医疗器械产品在整个储存和运输过程中保持其预期性能的关键指标;它不仅涉及产品的性能稳定性,还包括包装材料对产品无菌保持的能力。
(1)加速稳定性试验
定义:加速稳定性试验是将样品贮存在某一较高的温度,以缩短时间来模拟实时老化的试验。
加速稳定性试验设计是建立在假设材料变质所涉及的化学反应遵循阿列纽斯(Arrhenius)反应速率函数基础上的。该函数以碰撞理论为基础,确认化学反应产生变化的反应速率的增加或降低按照以下公式进行:

需要注意的是,并不是所有材料/组件的老化均符合该函数的热力学老化特性。注册申请人在使用该函数进行加速稳定性试验设计之前需考虑其适用性;
大量化学反应的研究结果表明温度升高或降低10℃会导致化学反应速率增加一倍或减半。则可根据阿列纽斯反应速率函数建立加速老化简化公式:
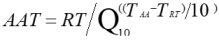
AAT:加速老化时间;RT:实时老化时间;Q10:温度升高或降低10℃的老化系数;TAA:加速老化温度;TRT:预设的实际贮存温度。
上述公式反映了加速稳定性试验中加速老化时间与对应的实时老化时间的关系。
其中,Q10一般设定为2,也可保守设定为1.8。如注册申请人在加速稳定性试验中设定的Q10大于2,则需同时提供详细的相关研究资料。
(2)温度
加速老化涉及的温度有TAA:加速老化温度;TRT:预设的实际贮存温度,这两个温度会影响加速老化时间的设定,1)关于TAA--设定较高的加速老化温度TAA可减少加速稳定性试验的时间。但是,由于较高的温度(如高于聚合物玻璃化转变温度)可能导致医疗器械原材料、组件和/或包装材料的性质发生改变或引发多级或多种化学反应,造成试验结果的偏差。因此,加速老化温度一般不宜超过60℃。如注册申请人在加速稳定性试验中设定了更高的加速老化温度,亦需提供详细的相关研究资料;2)关于TRT--根据标准YY/T 0681.1-2018 无菌医疗器械包装试验方法 第1部分:加速老化试验指南,预设的实际贮存温度一般为20℃~25℃,25℃被认为是保守的温度值;
(3)湿度
在加速及实时稳定性研究中,申请人宜根据产品特性和预期贮存条件进行评估选择合适的相对湿度,并提供选择的理由和依据。一般建议相对湿度60%±10%;
若湿度在有效期内对产品性能影响显著,建议申请人设置高湿度和/或低湿度等条件,对产品进行最不利条件性能验证。若相对湿度在有效期内对产品影响不大,可不对相对湿度进行特殊要求;
(4)样品批次
在2017年修订的《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》中规定医疗器械货架验证建议至少包括三个代表性批次的产品,推荐采用连续三批次样品进行验证;但这一要求,在2022年修订的《无源植入性医疗器械稳定性研究指导原则》中取消了这一要求,因此按照最新的指导原则来讲,可以不采取连续三个批次的产品作为验证的对象。


全部 0条评论