知识分享|GMP中的变更控制
1.变更的概念:
变更:任何对已确定的产品、工艺、工艺环境(或场所)、物料、设施、设备、标准、检验方法、GMP文件、计算机系统等各项内容的修改行为;它有可能定性或定量的影响产品组成、质量、外观、功能或稳定性。
也就是说,只要是影响产品质量的任何方面发生变化都是变更,根据影响产品质量的严重程度,确定变更的类型(主要变更和次要变更),分别进行不同程度的控制。
2.法规要求:
第二百四十条 企业应当建立变更控制系统,对所有影响产品质量的变更进行评估和管理。需要经药品监督管理部门批准的变更应当在得到批准后方可实施。
第二百四十一条 应当建立操作规程,规定原辅料、包装材料、质量标准、检验方法、操作规程、厂房、设施、设备、仪器、生产工艺和计算机软件变更的申请、评估、审核、批准和实施。质量管理部门应当指定专人负责变更控制。
第二百四十二条 变更都应当评估其对产品质量的潜在影响。企业可以根据变更的性质、范围、对产品质量潜在影响的程度将变更分类(如主要、次要变更)。判断变更所需的验证、额外的检验以及稳定性考察应当有科学依据。
第二百四十三条 与产品质量有关的变更由申请部门提出后,应当经评估、制定实施计划并明确实施职责,最终由质量管理部门审核批准。变更实施应当有相应的完整记录。
第二百四十四条 改变原辅料、与药品直接接触的包装材料、生产工艺、主要生产设备以及其他影响药品质量的主要因素时,还应当对变更实施后最初至少三个批次的药品质量进行评估。如果变更可能影响药品的有效期,则质量评估还应当包括对变更实施后生产的药品进行稳定性考察。
第二百四十五条 变更实施时,应当确保与变更相关的文件均已修订。
第二百四十六条 质量管理部门应当保存所有变更的文件和记录。
法规对变更的范围、类型、职责、实施都做了阐释,接下来我们对变更进行进一步的探讨。
3.为什么要进行变更控制
QA是变更的组织者和记录者,而变更的发起者可能是任何岗位的任何人员。目前的现状是很多变更QA都不掌握,之所以出现这种情况,原因有二:1是大家不了解变更控制的重要性,主观上忽略;2是因为变更的流程负责,特别是需要进行验证或稳定性试验,需要药监备案或批准的变更,所以大家就默默地变更了,但是没有按照流程进行变更控制。
那么,为什么上述变化都要被控制和管理呢?因为任何变化都有可能影响产品的质量。只有所有的变更都被控制、被证明没有影响到产品的质量,才能够进行变更。这也正是企业实施变更控制的目的和作用之一。
企业实施变更控制的其他目的和作用:
1)确保标准的权威性,防止随意变化。
2)确保持续改进得到了及时有效的执行,并高度保证变更不会引发不期望的后果。
3)从法规角度需要进行必要的变更审批程序。
4)变更管理体系强调QA的质量参与力度,履行必要的调查。
5)便于质量追溯,进行质量跟踪。
6)为质量信息系统提供基础信息。
4.什么情况下需要进行变更?
4.1变更范围:
4.1.1物料:原辅料、包装材料
4.1.2质量检验相关:质量标准、检验方法
4.1.3操作规程
4.1.4硬件设施:厂房、设施、设备、仪器、
4.1.5生产工艺
4.1.6计算机软件
4.1.7其他与产品质量有关的方面
4.2变更类型:
4.2.1按对产品质量的影响程度:
表1 按对产品质量影响程度的变更分类
| 变更类型 | 概念 | 变更内容 | 处理方式 |
|---|---|---|---|
| 主要变更 | 可能会对产品质量有显著性影响的变更 | 产品注册标准的变更; 内包装材质的变更; PC存条件、标签及说明书的变更; 关键合成路线、主要原料或溶剂、关键工艺参数、处方发生改变; 运行方式及构造发生改变的设备变更; 生产厂址的变更等 | 需要向药监管理部门提交文件申请批准的变更归属于该类变更,在阐述这部分内容时应根据药监部门公布的文件为准。 |
| 次要变更 | 对产品内在质量(安全性、有效性)存在潜在影响的变更 | 生产和质量的主要设备、设施、仪器的关键部件的更换; 关键原辅料的生产合成工艺、质量标准或供应商的改变; 清洁方法的改变; 包装规格和标签变更; GMP文件的改变等; | 可能需要给药政部门备案但不需要批准。 |
| 微小变更 | 对产品的安全性和有效性不会产生不良影响的变更 | 设备设施辅助配件的更换; 质量标准未改变的原辅料供应商的变更; 其他相关微小变更 | 这类变更不需要向药监部门申请批准或备案,但是需要在企业内部记录 |
如何确定变更的类型:进行变更评估,评估变更对质量的影响。
注意: 改变原辅料、与药品直接接触的包装材料、生产工艺、主要生产设备以及其他影响药品质量的主要因素时,还应当对变更实施后最初至少三个批次的药品质量进行评估。如果变更可能影响药品的有效期,则质量评估还应当包括对变更实施后生产的药品进行稳定性考察。
4.2.2按变更计划性:
4.2.2.1计划型变更
计划型变更一般指因为工艺、技术提升,法规和药典改版等引起的变更,一般由质量部统一发起,相关部门协同完成。
4.2.2.2非计划型变更
非计划型变更一般指因确认与验证、偏差、风险评估等实施过程中制定纠正和预防措施(CAPA),在CAPA的实现过程中引起的变更。一般由CAPA的实施部门发起。
4.2.3按变更时限:
永久性变更和临时性变更
5.怎样进行变更?即变更流程

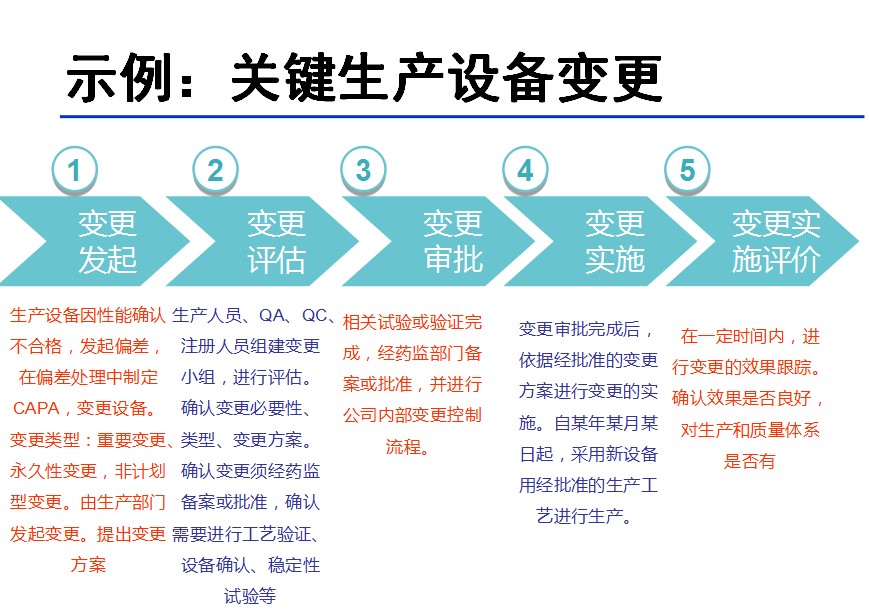
图2 变更示例
6.总结
偏差、风险评估、确认与验证、自检、稳定性考察都可能会产生纠正和预防措施,纠正和预防措施的制定和实施中,可能会产生变更。质量保证体系正是在不断的发现问题、处理问题、解决问题的过程中不断进步和持续改进。各质量要素的关系见图3:

图3 质量保证各要素的关系
【本文来源:张云;微信号:zhangyun_sunshine,欢迎同行一起交流】

全部 0条评论