知识分享|国家药监局《药品抽样原则及程序》正式发布!
今日,国家药监局正式发布《药品抽样原则及程序》,解读如下:
关于抽样量,一般应为检验需求的2倍量,按1:0.5:0.5的比例分装为3份。
同一品种存在不同制剂规格和包装规格时,应当以不同规格计算制剂单位,然后分别折算所抽取样品的最小包装数量(如:注射用无菌粉末以克为单位计算后再折算为瓶、液体制剂以毫升为单位计算后再折算为支或瓶等),同时应满足特殊检验项目(如:微生物限度等)对最小独立包装数量的要求。
明确样品抽样应为有偿购买,并对样品购买作了详细规定。
关于抽样批的确定:库存批数少于等于计划抽样批数时,各批均为抽样批;库存批数多于计划抽样批数时,应随机抽取。可参照简单随机或分层比例随机等方法确定抽样批。
简单随机方法:在抽取同一药品上市许可持有人生产的药品时,首先将药品批号进行编码,然后分别采取抽签、掷骰子、查阅随机数表或者用计算机发随机数等简单随机方法确定抽样批。
分层比例随机方法:如在抽取多个药品上市许可持有人生产的药品时,首先按药品上市许可持有人产品质量信誉的高低分为若干层次(例如可以分为A、B、C三层),然后按照质量信誉高的少抽、质量信誉低的多抽的原则,确定各层次药品上市许可持有人的抽样比例(例如1:2:3),确定各层次药品上市许可持有人的抽样批数,最后按简单随机抽样法确定抽样批。抽样人员可根据实际情况采用科学合理的分层随机方法。
关于抽样单元数(n)的确定
均质性和正常非均质性原料药:当一批药品的包装件数(N)不多于100件时,抽样单元数(n)按下表确定:

当一批药品的包装件数(N)超过100件时,抽样单元数(n)按下式计算确定:
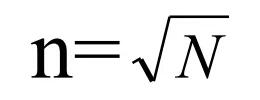
异常非均质性原料药:将该批原料药的各个包装件均作为抽样单元,即n = N。
制剂:计划抽取的样品数少于6个最小包装时,应当从相应数量的抽样单元中取样(如需抽取4个最小包装,应当从4个抽样单元中各取1个最小包装);计划抽取的样品等于或者多于6个最小包装时,则应当从6个抽样单元中抽样,并且从各单元中抽取的最小包装数应当大致相等(如须抽取12个最小包装,应当从6个抽样单元中各取2个最小包装单位)。

药品抽样原则及程序
1 适用范围
本原则及程序适用于依据《药品质量抽查检验管理办法》实施的抽样工作。国家有关法律法规、《中华人民共和国药典》以及规范性检查、稽查执法等药品监管工作另有规定的,执行相应规定。
2 术语和定义
本原则及程序采用下列定义。
2.1 批号
用于识别一个特定批的具有唯一性的数字和(或)字母的组合。
2.2 抽样批
施行抽样的同一批号药品。
2.3 抽样单元
施行抽样的便于清点、搬运和存放的药品包装单位。
2.4 单元样品
从一个抽样单元中抽取的样品为单元样品。
2.5 最小包装
直接接触药品的最小包装单位,对于20ml以下(含20ml)安瓿、口服液、小瓶固体注射剂等,可将放置此类包装的包装单位(如:盒)视为“最小包装”。
2.6 均质性药品
性质和质量均匀一致的同一批药品。抽样过程的均质性检查主要是检查药品外观性状的均质性。
2.7 非均质性药品
不同部分的性质和质量有所差异的同一批药品。
2.8 正常非均质性药品
正常理化属性可呈现为非均质性但不改变其性质和质量的同一批药品(如:混悬液及低温下可析出部分结晶而复温后能恢复原来状态的液体药品)。
2.9 异常非均质性药品
生产或者贮运过程中因未按正常工作程序操作等因素造成非均质性的同一批药品。
2.10 最终样品
由不同单元样品汇集制成的供检验或查处物证等使用的样品。
3 抽样原则
3.1 科学性,取样操作、贮运过程应科学合理,保证样品质量。
3.2 规范性,抽样程序应规范、有序,不得随意更改。
3.3 合法性,抽样工作应符合《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》和《药品质量抽查检验管理办法》等法律法规和规范性文件要求。
3.4 公正性,在抽样过程中,抽样人员应不徇私情、客观公正。
3.5 代表性,抽取的样品应能够较真实地反映抽样时所代表数量的药品实际质量状况。
4 抽样量确定
4.1 编制抽检计划或抽样方案时,应当根据标准检验、补充检验方法和(或)探索性研究的检验需求确定抽样量。
4.2 抽样量一般应为检验需求的2倍量,按1:0.5:0.5的比例分装为3份。
4.3 同一品种存在不同制剂规格和包装规格时,应当以不同规格计算制剂单位,然后分别折算所抽取样品的最小包装数量(如:注射用无菌粉末以克为单位计算后再折算为瓶、液体制剂以毫升为单位计算后再折算为支或瓶等),同时应满足特殊检验项目(如:微生物限度等)对最小独立包装数量的要求。
4.4 应当根据合理套用的原则确定抽样量,不应按单个检验项目简单累加(如:注射液在进行可见异物检查后再进行其他项目的检验)。
5 安全防护
5.1对放射性、毒性、腐蚀性或者易燃易爆等样品抽样时,抽样人员在实施现场抽样时应配戴必要的防护用具(如:防护衣、防护手套、防护镜或者防护口罩等),并做到轻取轻放,同时应当在样品外包装加注危险品标识,以防止发生意外事故。
5.2 易燃易爆样品应当远离热源。
6 抽样程序
6.1 抽样前准备
6.1.1人员要求
抽样人员应当熟悉《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品生产质量管理规范》《药品经营质量管理规范》和《药品质量抽查检验管理办法》等法律法规和规范性文件,了解《中华人民共和国药典》等药品标准要求,熟悉药品的外观状态、正常标识、贮藏条件等要求,并可对异常情况做出基本判断。
抽样人员应当正确掌握各类抽样方法,熟练使用采样器具。
抽样队伍应当相对稳定,定期接受法律法规和专业技术培训。
6.1.2 人员组织
抽样单位应根据当次抽样工作的目标要求,组建相应数量的抽样工作组,每个抽样工作组的人员应不得少于2人。原则上同一人不应同时承担当次抽样和检验工作。
抽样单位应当围绕抽样任务要求对抽样人员进行专题培训,抽样人员应当认真研究背景资料,对抽检要求做出基本判断,确定现场检查和抽样的具体事项,必要时与承检机构对检验项目、抽样环节和抽样数量等具体事宜进行商定。
6.1.3 取样工具
直接接触药品的取样工具,使用前后应当及时清洁干燥,不与药品发生化学反应,不对抽取样品及剩余药品产生污染。
抽取粉末状固体样品和半固体样品时,一般使用一侧开槽、前端尖锐的不锈钢抽样棒取样,也可使用瓷质或者不锈钢质药匙取样。
抽取低粘度液体样品时,根据不同情形分别使用吸管、烧杯、勺子、漏斗等取样;抽取腐蚀性或者毒性液体样品时,需配用吸管辅助器;抽取高粘度液体样品时,可用玻璃棒蘸取。
抽取无菌样品或者需做微生物检查、细菌内毒素检查等项目的样品时,取样工具须经灭菌或除热原处理。
6.1.4 包装容器
直接接触药品的包装容器材质,应当不与内容物发生化学反应,具有良好阻隔性能,并满足药品的贮藏条件,潜在迁移物质不影响检验结果。抽样前应查看包装容器外包装的完整性。
直接接触药品的包装容器的形状与规格,应当与所抽取样品的形态和数量相适应,液体样品的存放可选用瓶状密闭容器,固体样品可选用袋状容器。
直接接触无菌样品或者需做微生物检查、细菌内毒素检查等项目样品的容器须经灭菌或除热原处理,且具有密封性能。
6.1.5 文件与凭证
抽样人员抽样前,应当查验抽检的工作计划或实施方案、委托书或行政执法证、样品封签(附1)、药品抽样记录及凭证(附2)、药品抽样告知及反馈单(附3)、样品(物证)密封袋等必要的证明凭证。
6.2 抽样现场检查
6.2.1 抽样人员应当查看被抽样单位生产经营使用资质及相关材料,实地查看贮藏场所环境控制措施、运行状态及监控记录、存放标识等情况,现场查验包装标签标示的名称、批准文号、批号、有效期、药品上市许可持有人等内容,查验药品外观包装(如破损、受潮、受污染或假冒迹象等)。
6.2.2 现场检查中发现疑似药品质量问题情形时,可针对性抽样;如发现影响药品质量的潜在问题或存在违法违规生产经营使用行为的,应当固定相关证据,并将相关证据或样品移交对被抽样单位具有管辖权的药品监督管理部门处置。
6.3抽样
6.3.1 现场抽样方法、抽样单元数(n)和抽样单元的确定
现场抽样方法、抽样单元数(n)和抽样单元的确定,可参照附4进行。
6.3.2 取样方法与最终样品的制作
中药材和中药饮片应当参照《中华人民共和国药典》“药材和饮片取样法”规定的方法取样。除特殊情况外,应从未拆封的完整包装的样品中抽取,并对包装情况留存相关证据。
制剂、原料药的取样方法与最终样品的制作可参照附5进行。
对于特殊样品可由抽样人员随机指定被抽样本,陪同或监督被抽样单位的质量人员现场抽样。
6.4 包装、签封、记录和信息报送
6.4.1 包装
每份样品应分别包装并封口,并按照说明书规定的条件保存。
6.4.2 签封
抽样人员应使用专用封签(见附1)签封样品,完整、准确填写封签内容,由抽样人员和被抽样单位相关人员共同签字,并加盖印章或指模;签封应达到保证无法调换样品的目的。
6.4.3 记录
抽样人员应当完整、准确、规范填写专用的《药品抽样记录及凭证》(附2)及《药品抽样告知及反馈单》(附3),由抽样人员和被抽样单位相关人员签字,并加盖印章或指模。
在抽样过程中,可通过拍照、录像、留存相关票据的方式对抽样过程、样品信息、抽样环境等信息予以记录
6.4.4 信息报送
抽样人员完成现场抽样后,应当按照有关工作要求通过相应的信息平台,及时报送抽样信息。
6.5 贮藏运输
6.5.1 样品在贮藏运输过程中,应当按照贮藏运输条件的要求,采取相应措施并记录,确保全程符合药品贮藏条件,保证样品不变质、不破损、不污染。
6.5.2 样品一般应由抽样人员寄(送)至承检机构,需要委托他人运输时,应当选择具备相应贮藏运输资质和条件的单位,必要时应签订运输、贮藏条件保障协议,避免样品在运输过程中发生丢失、错递、污染变质等问题。
6.5.3 特殊药品的贮藏运输,应当按照国家有关规定执行。
6.5.4 根据抽检计划或实施方案要求,应将抽样文书及相关资料随样品寄(送)至承检机构。
7 样品购买
药品监督管理部门在制定抽检计划或实施方案时,应明确购买样品的结算方式、结算时限和支付单位(可以是抽检组织部门、抽样单位、检验单位等)。
抽样人员完成抽样并填报购样信息后,收款单位(可以是使用单位、销售单位、生产单位或药品上市许可持有人等)应在规定时限内凭相关票据和《药品抽样记录及凭证》规定的结算方式提请结算,超出结算时限的,作为自愿放弃有关权利处理,视作无偿提供样品。支付单位应在规定时限内审核并结算。
7.1 结算方式
现场结算。抽样人员在抽样时以刷银行卡等方式现场结算购样费用,在《药品抽样记录及凭证》上标明,并由被抽样单位向抽样单位开具票据,支付凭证由抽样单位留存。
非现场结算。完成抽样后,抽样人员填写《药品抽样记录及凭证》,被抽样单位向抽检组织部门指定的支付单位开具票据,支付单位按照《药品抽样记录及凭证》填写的价格,向被抽样单位支付购样费用,支付凭证由支付单位留存。
持有人结算。完成抽样后,抽样人员填写《药品抽样记录及凭证》,被抽样单位凭《药品抽样记录及凭证》向进货单位申请补货,药品上市许可持有人凭补货时传递的《药品抽样记录及凭证》,向抽检组织部门指定的支付单位提请结算,并向支付单位开具相关票据,支付单位按规定向药品上市许可持有人支付样品费用,支付凭证由支付单位留存。
其他结算方式。经组织当次抽检的药品监督管理部门同意,抽样单位和被抽样单位协商一致,可采用其他结算方式及协商的价格完成购样,但必须留存相关的依据和凭证,并在《药品抽样记录及凭证》中予以注明。
7.2 支付价格
向药品经营和使用单位支付的,一般以抽样时的实际销售价格为准;向药品上市许可持有人支付的,一般以该样品的出厂价格为准。支付价格由收款单位如实提供。
7.3 其他事项
抽样完成后,因各种原因造成样品无法检验的,仍应支付购样费用。
收款单位应根据药品抽检任务性质和要求,向支付单位分别开具与《药品抽样记录及凭证》相对应的票据,避免混淆。
7.4 信息填报
抽样人员在填写《药品抽样记录及凭证》中抽样信息或在抽样系统中在线填报时,应准确填写结算方式、样品单价、总价等购样所需信息。
附:
1.样品封签
2.药品抽样记录及凭证
3.药品抽样告知及反馈单
4.现场抽样的有关参考方法
5.取样方法与最终样品的制作

全部 0条评论