分享|9205 药品洁净实验室微生物监测和控制指导原则 (修订 )
来源:药典委
9205 药品洁净实验室微生物监测和控制指导原则 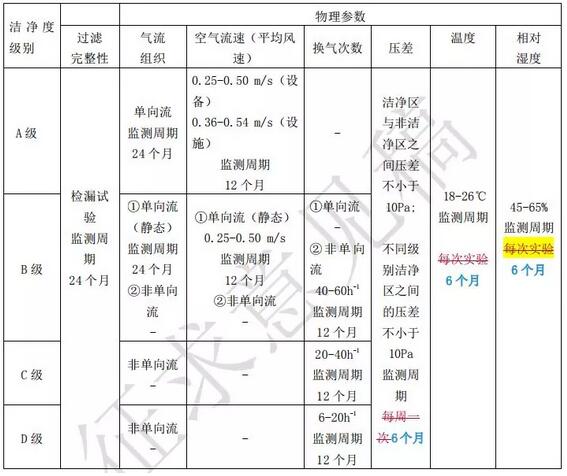 监测
药品洁净实验室应进行日常监测和定期监测,日常监测一般包 括压差、温度、相对湿度;定期监测应在风险评估的基础上建立洁净环境监 测计划。定期监测内容包括物理参数、非生物活性的空气悬浮粒子和有生物活性 的微生物监测,其中微生物监测包括环境浮游菌和沉降菌监测,及关键的检测台 面、人员操作服表面及 5 指手套等的微生物检测。
当洁净区有超净工作台、空气调节系统等关键设备发生重大改变时应重新进行监测;当微生物监测结果或样品测定结果产生偏离,经评估洁净区可能存在 被污染的风险时,应对洁净区进行清洁消毒后重新进行监测。
监测
药品洁净实验室应进行日常监测和定期监测,日常监测一般包 括压差、温度、相对湿度;定期监测应在风险评估的基础上建立洁净环境监 测计划。定期监测内容包括物理参数、非生物活性的空气悬浮粒子和有生物活性 的微生物监测,其中微生物监测包括环境浮游菌和沉降菌监测,及关键的检测台 面、人员操作服表面及 5 指手套等的微生物检测。
当洁净区有超净工作台、空气调节系统等关键设备发生重大改变时应重新进行监测;当微生物监测结果或样品测定结果产生偏离,经评估洁净区可能存在 被污染的风险时,应对洁净区进行清洁消毒后重新进行监测。
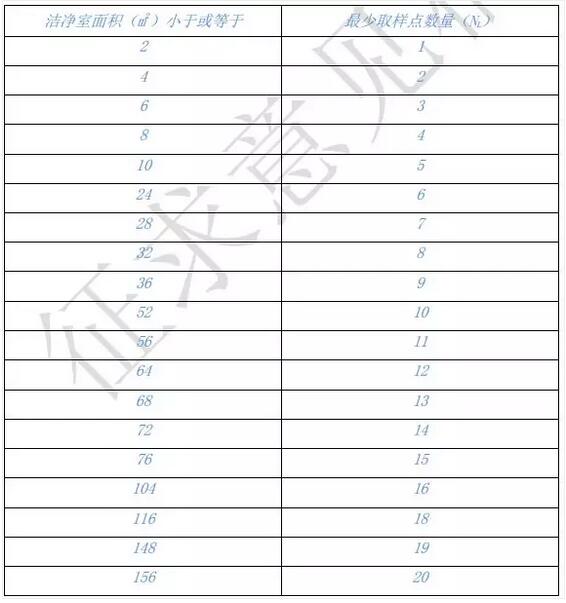 注:面积处于两数之间的,取两者之间的较大数值。
取样量和取样时间 各取样点的单次取样量公式如下:
注:面积处于两数之间的,取两者之间的较大数值。
取样量和取样时间 各取样点的单次取样量公式如下:
 微生物监测
微生物监测
 注:
注:
注:
注: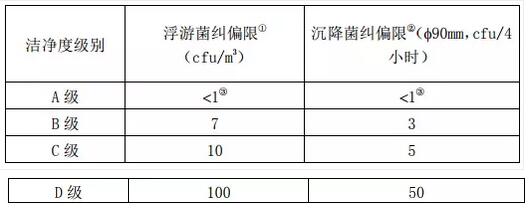 注:
注:
药品洁净实验室是指用于药品无菌或微生物检验用的洁净实验室、隔离系 统及其它受控环境。药品洁净实验室的洁净级别按空气悬浮粒子大小和数量的不 同参考现行“药品生产质量管理规范”分为 A、B、C、D 4 个级别。为维持药品 洁净实验室操作环境的稳定性、确保药品质量安全及检测结果的准确性,应对药 品洁净实验室进行微生物监测和控制,使受控环境维持可接受的微生物污染风险 水平。
本指导原则包括人员要求、初次使用的洁净实验室参数确认、微生物监测 方法、监测频次及监测项目、监测标准、警戒限和纠偏限、数据分析及偏差处理、 微生物鉴定和微生物控制。
人员
从事药品洁净实验室微生物监测和控制的人员应符合现行《中国药典》通则 中“药品微生物实验室质量管理指导原则(通则 9203)”的相关要求。
确认
初次使用的洁净实验室应进行参数确认,确认参数包括物理参数、空气悬 浮粒子和微生物。洁净实验室若有超净工作台、空气调节系统等关键设备发生重 大变化时应重新进行参数测试。
药品洁净实验室物理参数的测试应当在微生物监测方案实施之前进行,确 保操作顺畅,保证设备系统的运行能力和可靠性。主要的物理参数包括高效空气 过滤器完整性、,气流组织、空气流速(平均风速),换气次数、压差、温度和相 对湿度等。测试应一般首先在静态下测试,符合要求后再在模拟正常检测条件下 进行测试。
各级别洁净环境物理参数建议标准及最长监测周期见表 1,必要时,各实验 室应根据洁净实验室使用用途、检测药品的特性等制定适宜的参数标准。物理参 数测试方法参照《洁净室施工及验收规范》的现行国家标准中附录 D3 高效空气 过滤器现场扫描检漏方法、附录 E12 气流的检测、附录 E1 风量和风速的检测、 附录 E2 静压差的检测、附录 E5 温湿度的检测进行。
初次使用的洁净实验室其空气悬浮粒子和微生物的确认及监测照以下“监 测”进行。
表 1 各级别洁净环境物理参数建议标准及最长监测周期

悬浮粒子监测
1. 悬浮粒子监测方法
除取样点的选择和数量、取样量和取样时间外,药品洁净实验室悬浮粒子 的监测参考《医药工业洁净室(区)浮粒子的测试方法》的现行国家标准进行。
取样点的选择和数量 取样点的选择应具有代表性,应考虑洁净室布局、 设备配置和气流系统的特点,可以根据风险情况在最少取样点数量基础上增加 取样点。推荐最少取样点数量(NL)见表 2。
表 2 推荐洁净室最少取样点数量(NL)


式中 Vs 代表取样点单次取样最低量,用升表示。
Cn,m 代表相关等级规定的最大被考虑粒径之等级限值(每立方米的 粒子数量)。
20 代表当粒子浓度处于该等级限值时,可被检测到的粒子数。
每个取样点的取样量至少为 2 升,取样时间最少为 1 分钟。各取样点的单 次取样量应相同。
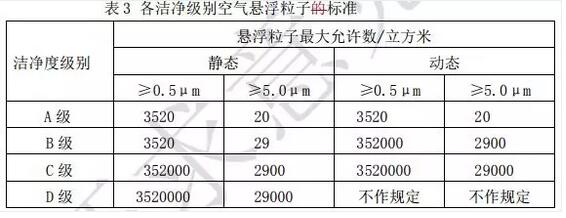
2. 悬浮粒子监测标准
各洁净级别空气悬浮粒子标准见表 3。
表 3 各洁净级别空气悬浮粒子标准

1. 微生物监测方法
药品洁净实验室沉降菌的监测照《医药工业洁净室(区)沉降菌的测试方 法》的现行国家标准进行;浮游菌的监测照《医药工业洁净室(区)浮游菌的测 试方法》的现行国家标准进行,浮游菌采样器可选择撞击式采样器或滤膜式采样 器等。
表面微生物测定是对环境、设备和人员的表面微生物进行监测,方法包括接 触碟法和擦拭法。接触碟法是将充满规定的琼脂培养基的接触碟对规则表面或平面进行取样,然后置合适的温度下培养一定时间并计数,每碟取样面积约为 25 cm 2,微生物计数结果以 cfu/碟报告;擦拭法是接触碟法的补充,用于不规则表 面的微生物监测,特别是设备的不规则表面。擦拭法的擦拭面积应采用合适尺寸 的无菌模板或标尺确定,取样后,将拭子置合适的缓冲液或培养基中,充分振荡, 然后采用适宜的方法计数,每个拭子取样面积为约 25 cm2,微生物计数结果以 cfu/拭子报告。接触碟法和擦拭法采用的培养基、培养温度和时间同浮游菌或沉 降菌监测。表面菌测定应在实验结束后进行。
环境浮游菌、沉降菌及表面微生物监测用培养一般采用胰酪大豆胨琼脂培 养基(TSA),培养温度为 30℃~35℃,时间为 3~5 天,必要时可加入适宜的中 和剂。当监测结果有疑似真菌或考虑季节因素影响时,可增加沙氏葡萄糖琼脂 培养基(SDA),培养温度为 20℃~25℃,时间为 5~7 天。如需要,应根据环境 污染微生物种群特性选择特定的培养条件和培养时间。
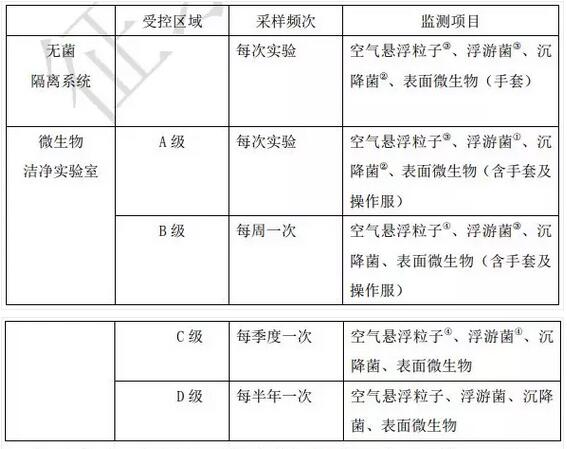
2.监测频次及项目
在药品洁净实验室监控中,监测频次及监测项目建议按表 4 进行。
如果出现连续超过纠偏限和警戒限、关键区域内发现有污染微生物存在、空 气净化系统进行任何重大的维修、消毒规程改变、设备有重大维修或增加、洁净 室(区)结构或区域分布有重大变动、引起微生物污染的事故、日常操作记录反 映出倾向性的数据时应考虑修改监测频次。
表 4 推荐的药品洁净实验室的监测频次及监测项目

①每月一次。
②工作台面沉降菌的日常监测采样点数不少于 3 个,且每个采样点的平皿数应不 小于 1 个。
③每季度一次。
④每半年一次。
3.微生物监测 -标准
各洁净级别环境微生物监测的动态标准详见表 5。
表 5 各洁净级别环境微生物监测的动态标准①
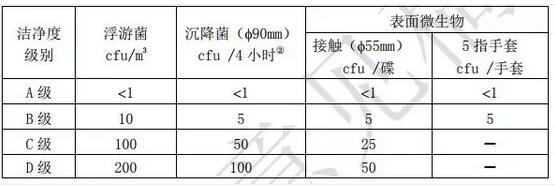
①表中各数值均为各个取样点的平均值;
②单个沉降碟的暴露时间可以少于 4 小时,同一位置可 使用多个沉降碟连续进行监测并累积计数。
4. 警戒限和纠偏限
药品洁净实验室应根据历史数据,结合不同洁净区域的标准,采用适宜的方 法,制定适当的微生物监测警戒限和纠偏限。限度确定后,应定期回顾评价,如 历史数据表明环境有所改善,限度应作出相应调整以反映环境实际质量状况。表 6 列出了各级别洁净环境微生物纠偏限参考值。
表 6 各级别洁净环境微生物纠偏限参考值

①数据表示建议的环境质量水平,也可根据检测或分析方法的类型确定微生物纠偏限度标准;
②可根据洁净区域用途、检测药品的特性等需要增加沉降碟数。
③A 级环境的样品,正常情况下应无微生 物污染。
数据分析及偏差处理
1.数据分析
应对日常环境监测的数据进行分析和回顾,通过对收集的数据和趋势分 析,总结和评估洁净实验室是否受控,评估警戒限和纠偏限是否适合、及 所采取的纠偏措施是恰当。
应正确评估微生物污染,不仅关注微生物数量,更应关注微生物污染检 出的频率,通常在一个采样周期内同一环境中多点发现微生物污染,可能预 示着风险增加,应仔细评估。几个位点同时有污染的现象也可能由不规范的采样 操作引起,所以在得出环境可能失控的结论之前,应仔细回顾采样操作过程。在 污染后的几天对环境进行重新采样对于调查污染原因意义不大,因为采样过程不 具有可重复性。
2.偏差处理
当微生物监测结果超出纠偏限度时,应当按照偏差处理规程进行报告、记录、 调查、处理以及采取纠正措施,并对纠正措施的有效性进行评估。
3.微生物鉴定
建议对受控环境收集到的微生物进行适当水平的鉴定,微生物菌群信息有助 于预期常见菌群,并有助于评估清洁/消毒规程、方法、清洁/消毒剂及微生物监 测方法的有效性,尤其当超过监测限度时,微生物鉴定信息有助于污染源的调查。 关键区域分离到的菌落应先于非关键区域进行鉴定。微生物鉴定参照微生物鉴定 指导原则(通则 9204)进行。
微生物控制
为了保证药品洁净实验室环境维持适当的水平,应保持空调系统的良好运行 状态,对设施进行良好维护,洁净室内人员应严格遵守良好的行为规范,并定期 进行环境监测。微生物控制措施还包括良好的清洁和卫生处理,应定期对药品洁 净实验室进行清洁和消毒,应监测消毒剂和清洁剂的微生物污染状况,并在规定的有效期内使用,A/B 级洁净区应使用无菌的或经无菌处理的消毒剂和清洁 剂。所采用的化学消毒剂应经过验证或有证据表明其消毒效果,其种类应当多于 一种,并定期进行更换以防止产生耐受菌株。不得用紫外线消毒代替化学消毒。 必要时,可采用气体、熏蒸等适宜的方法降低洁净区的卫生死角的微生物污染, 并对消毒剂的残留水平进行验证。

全部 0条评论