马来西亚医疗器械认证注册流程
监管机构
马来西亚医疗器械注册由卫生部(Ministry of Health, Malaysia, 简称MOH)下属的医疗器械管理局(MDA)监管,确保所有医疗器械的安全性和有效性。
主要法规
医疗器械条例2012(Medical Device Regulations 2012)
医疗器械法案(Medical Device Act 2012)
参考法规
国际医疗器械监管机构论坛(International Medical Device Regulators Forum, IMDRF)指南
东盟医疗器械指令(ASEAN Medical Device Directive)
医疗器械风险分类
通过以下分类,确保不同风险等级的医疗器械得到适当的监管:
Class A:低风险(如手术牵开器/压舌器)
Class B:低-中风险(如皮下针/吸引设备)
Class C:中-高风险(如肺呼吸机/骨科植入物)
Class D:高风险(如心脏瓣膜/植入式除颤器)
符合性评估路径
CAB提供两种评估路径,以适应不同医疗器械的需求:
全流程路径(Full CA):适用于大多数医疗器械。
验证注册(CA by way of verification):适用于已在参考国注册的医疗器械。
参考国
* 澳大利亚药品管理局TGA
* 加拿大卫生部HC
* 欧盟公告机构EU NB
* 日本厚生劳动省MHLW
* 美国食品药品管理局FDA
* 其他国外监管机构或公告机构 (由MDA确定)
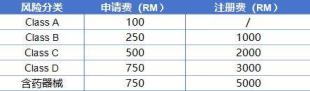
MDA官方费用
费用根据不同的风险分类而定,确保制造商能够根据自身产品的风险等级合理规划成本。
审批时间
注册时间根据产品风险等级分类的不同:从低风险产品的6-8周到高风险产品的约3-6个月不等。
申请资料
符合性声明(Declaration of Conformity)
产品技术文件(Common Submission Dossier Template, CSDT)
上市历史和警戒声明(Risk management documentation)
说明书、标签
QMS证书等
注册申请流程
通过马来西亚医疗器械集中网上申请系统MeDC@st v.20线上提交,简化您的注册过程。
注册证有效期
注册成功后,医疗器械注册证书有效期为5年。
语言要求
家用器械说明书和标签必须翻译成马来文,专业人士使用的说明书和标签可以用英文。
注册资格
海外制造商需要指派一名当地授权代表,该代表必须是马来西亚公民或永久居民,并持有营业执照和医疗器械良好分销规范(GDPMD)证书。
证书转让
许可证可以从一个授权代表转移到另一个,确保业务连续性和合规性。
医疗器械注册流程概述
确定产品是否属于医疗器械及风险分类
指定马来西亚法定代表
准备注册文件
提交注册文件至CAB
提交注册文件至MOH
获取医疗器械注册证书
合法进入马来西亚市场销售


全部 0条评论