医疗器械和材料生物学评价流程路径
按照GB/T42062-2022/ISO14971:2019《医疗器械风险管理对医疗器械的应用》开展风险管理,包括生物学危险(源)的识别、相关生物学风险的估计和风险可接受性的确定。这就对进行评价的人员提出较高的要求。生物学评价应由掌握理论知识和具有经验的专业人员来策划、实施并形成文件。在获取必要的物理/化学信息后,评价流程主要分为三条路径:
(一)路径一:等同性比较分析
即从材料配方、加工过程和灭菌、几何和物理特性以及人体接触方式和临床使用方式等方面来和已上市产品进行比较,进行等同性分析,进而完成生物学评价。
等同性的概念非常重要,科学地得出等同性结论能够减免不必要的试验,节省大量的人力、经费和时间成本。标准在评价流程图的起始点修改为获得物理/化学信息并考虑材料表征,强调器械材料的理化特性在生物学评价中的重要作用,并对等同性判断步骤的描述进行了修改,做这样的调整后,生物学评价中等同性判定程序变得更加严谨,在比以前增加了豁免试验机会的同时,也进一步强调了按程序进行生物学评价的重要性。标准中指出,如果表征结果表明某一医疗器械或材料与已经过评定具有明确安全性的医疗器械或材料具有生物学等同性,主要考虑配方和加工工艺、接触性质是相同的,相关生物相容性终点分析的临床信息是可获得的,则可能不需要进行试验。按照标准的要求,等同并不是相同,而是生物学等同性,也就是所选用的材料和生产过程引人物质的毒理学或生物学安全性不低于同类临床可接受材料的生物学安全性。
(二)路径二:已有毒理学数据分析
即确定从所获取的毒理学资料是否适用于待评价医疗器械,进而完成生物学评价依据已有毒理学数据进行毒理学风险评估可以有效完成生物学评价。标准中一方面增加了众多与生物学风险相关的毒理学术语,如可耐受摄入值(T)、可耐受接触量(TE)允许限量(AL)值、毒理学关注阈值(TTC)等。正确使用这些毒理学值,对医疗器械或材料的可沥滤物或可浸提物中靶物质进行毒理学风险评估,将会为豁免不必要的生物学试验提供可靠的证据。一般当可以获得充分信息对该医疗器械或材料进行毒理学风险评定时,试验通常是不必要的。这实际上也是对从事生物学评价人员的毒理学知识背景提出了更高的要求。
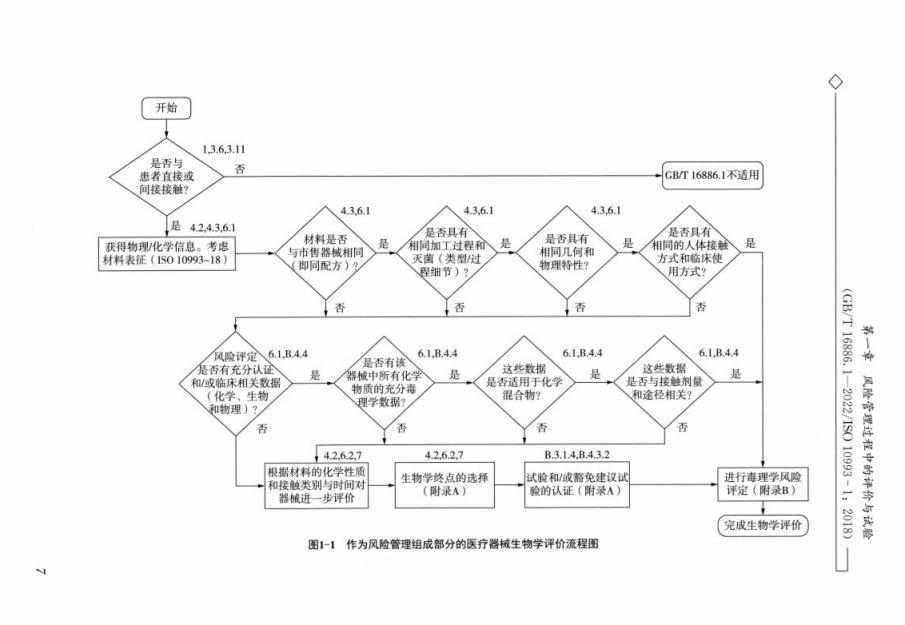
(三)路径三:终点评价
需要识别出数据缺口,选择相应的评价终点。即当路径一和路径二都无法顺利进行时通过材料表征和毒理学评价、生物学试验以及临床和动物试验数据等方式来证明安全性。
如果所评价的终产品不存在可比器械,则需要步人终点评价路径,即针对各个评价终点进行评价。一般可参照GB/T16886.1/ISO10993-1中的评价终点矩阵图,根据终产品与人体接触的途径和时间确定需要评价的约点,如细胞毒性等,但有些特殊的器械有特定的国家标准或行业标准要求,可按相关标冲进行选择。终点确定后,不同的终点可以选择共选择,即材料表征-毒理学评价、标准化的生不同的评价方式。有以下三种评价方式可物学试验和动物研究/临床数据。
1.材料表征-毒理学评价
即参照GB/T16886.18/ISO10993-18进行材料化学表征,参照 GB/T 16886.17/1SO10993-17进行毒理学评价。此种方式一般适用于评价系统性的毒性终点,如全身毒性、遗传毒性、生殖毒性、致癌性。当生物学试验的不确定度很高时,可以考虑采用材料表征-毒理学评价的方式作为补充,但这种方式一般不用于评价细胞毒性、致敏、植人后局部反应、血液相容性等终点。毒理学阈值(TTC)评价方法也属于此种方式。此种方式除了用于部分终点的评价,还用于医疗器械中具有一定毒性的加工助剂残留量的可接受性评价,如有机溶剂、交联剂残留量,也可用于评估当器械的原材料或加工助剂的来源或技术条件、产品某种次要成分、生产工艺或灭菌参数、初包装材料等发生改变时是否引人新的生物学风险,以及新的生物学风险是否可以接受。
2.标准化的生物学试验
采用终产品或有代表性的样品作为试验材料。无法直接试验的,通常用其浸提液进行试验。浸提的原则是尽可能与临床建立联系,在标准的浸提条件中尽可能选择更苛刻的条件,以获得更大的安全系数,如在材料不发生变化的情况下选择提取能力更强的浸提介质、更高的浸提温度、更高的浸提比例、更长的浸提时间等,但有时两种浸提条件之间相比并不存在绝对的严苛性。剂量选择也是在可行性和尽可能大的安全系数之间的平衡。对于多次使用的器械还需要考虑生物学反应的积累效应。需要确认生物学试验的样品能够代表最差状态,如货架储存时间的考虑。对于观察局部反应的试验(如植入试验、刺激试验等),样品制备时还需要考虑表面结构的影响。为便于结果的分析,生物学试验还需考虑是否设置对照,如阴性对照、阳性对照等。需注意的是,对于药械组合产品,生物学试验结果可能会受到干扰,需要考虑是否将终产品和不含药部分分别进行评价。当然,试验的质量控制也是非常重要的方面。
3.动物研究/临床数据
一般所说的动物研究指的是模拟临床使用途径的原位动物实验,主要用于医疗器械临床前可行性、有效性、安全性研究的目的。其并不能充分识别生物学风险,但在一些特殊情形中也可以起到补充生物相容性评价的作用。例如,当血栓形成试验中出现血栓评级较高的情况,可结合动物研究中的血栓形成数据对结果的可接受性进行综合评价。还有对于带有药物涂层的球囊扩张导管评价药物的亚慢性毒性时也可结合动物研究中的数据进行观察。但是,如果用动物研究方式代替部分生物学试验来评价医疗器械的生物相容性,则需考虑动物研究是否符合GB/T16886/ISO10993系列标准对于相应生物学试验的观察指标、观察时间点、动物数量、样品数量等具体要求。临床数据虽然是最接近医疗器械真实应用安全性、有效性的数据,但由于其样本量、观测方式、其他因素干扰等条件所限,对于生物学风险的识别可能并不是很敏感,因此临床数据一般不能直接用于生物相容性评价,但可作为产品生物相容性评价的有益补充,例如,对于某些生物学试验结果的临床可接受性评估具有重要参考意义。以上三种评价方式可以互相补充,对生物相容性评价提供完整证据链。如果评价数据为文献或历史数据,需要考虑适用性和数据质量等问题。
这三条路径中,路径一是最省时省力的评价方式,因此是优先推荐的方式,但是一般只有本企业器械才具有可比性。路径二强调了已有毒理学数据的使用,涉及到数据的来源、质量、分析等,对人员的能力要求相对较高。路径三是在路径一和路径二都行不通的基础上进行的,强调了数据缺口的识别以及终点评价方式的选择。


全部 0条评论