1、固态标准物质浓度计算时乘以标准物质的纯度,计算公式如下: 其中, C1:储备液的最终浓度mg/L;
其中, C1:储备液的最终浓度mg/L;
W1: 称取标准物质的质量mg;
10 定容体积,mL
2、称取10 mg标准物质时,因取用量少,且容量瓶口径小,一般用一次性吸管,将细端剪出凹槽,用其作为药匙使用;
3、标准物质取出后应先恢复至室温再进行称量;同理,储备液及工作液也应取出恢复室温后再开始使用;
4、标准物质开封后,应在瓶身标注编号及开封日期;
5、配置溶剂选取色谱纯;
6、最先考虑直接称量法,因其误差最小;
7、稀释标液时,移液体积不小于10微升;
8、标准物质配置过程中应及时认真填写标准物质配置记录及储备液稀释记录,保证其配置的标液相关信息以及浓度与填写的记录一致;
9、标签内容应标明:标准物质编号及中文,浓度,有效期及配置日期,配置人。
10、在配置易挥发标准物质时,称量样品质量不小于100Mg,以减少误差。
1 回答
1、固态标准物质浓度计算时乘以标准物质的纯度,计算公式如下: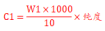 其中, C1:储备液的最终浓度mg/L;
其中, C1:储备液的最终浓度mg/L;
W1: 称取标准物质的质量mg;
10 定容体积,mL
2、称取10 mg标准物质时,因取用量少,且容量瓶口径小,一般用一次性吸管,将细端剪出凹槽,用其作为药匙使用;
3、标准物质取出后应先恢复至室温再进行称量;同理,储备液及工作液也应取出恢复室温后再开始使用;
4、标准物质开封后,应在瓶身标注编号及开封日期;
5、配置溶剂选取色谱纯;
6、最先考虑直接称量法,因其误差最小;
7、稀释标液时,移液体积不小于10微升;
8、标准物质配置过程中应及时认真填写标准物质配置记录及储备液稀释记录,保证其配置的标液相关信息以及浓度与填写的记录一致;
9、标签内容应标明:标准物质编号及中文,浓度,有效期及配置日期,配置人。
10、在配置易挥发标准物质时,称量样品质量不小于100Mg,以减少误差。