经验分享|医疗器械不良事件监测信息系统使用全攻略(第二期)——内含产品风险评价报告操作指南

医疗器械不良事件监测信息系统使用全攻略(第二期)
持有人个例上报
视频播放地址:
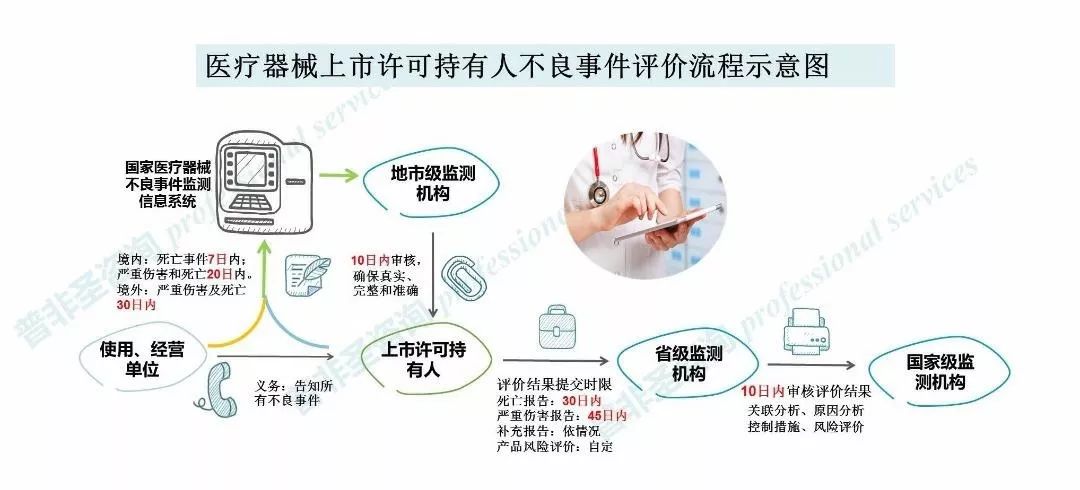
讲到报告,就要提到相关法规,根据《医疗器械不良事件监测和再评价管理办法》(国家市场监管总局第1号)(以下简称《办法》)第二十五条,持有人发现或者获知可疑医疗器械不良事件的,应当立即调查原因,导致死亡的应当在7日内报告;导致严重伤害、可能导致严重伤害或者死亡的应当在20日内报告。
以及第二十八条,设区的市级监测机构应当自收到医疗器械不良事件报告之日起10日内,对报告的真实性、完整性和准确性进行审核,并实时反馈相关持有人。
还有第二十九条,持有人在报告医疗器械不良事件后或者通过国家医疗器械不良事件监测信息系统获知相关医疗器械不良事件后,应当按要求开展后续调查、分析和评价,导致死亡的事件应当在30日内,导致严重伤害、可能导致严重伤害或者死亡的事件应当在45日内向持有人所在地省级监测机构报告评价结果。对于事件情况和评价结果有新的发现或者认知的,应当补充报告。
最后是第三十条,持有人所在地省级监测机构应当在收到持有人评价结果10日内完成对评价结果的审核,必要时可以委托或者会同不良事件发生地省级监测机构对导致或者可能导致严重伤害或者死亡的不良事件开展现场调查。其中,对于国家药品监督管理局批准注册的医疗器械,国家监测机构还应当对省级监测机构作出的评价审核结果进行复核,必要时可以组织对导致死亡的不良事件开展调查。
群体上报和审核
视频播放地址:
根据《办法》第三十一条,持有人、经营企业、使用单位发现或者获知群体医疗器械不良事件后,应当在12小时内通过电话或者传真等方式报告不良事件发生地省、自治区、直辖市药品监督管理部门和卫生行政部门,必要时可以越级报告,同时通过国家医疗器械不良事件监测信息系统报告群体医疗器械不良事件基本信息,对每一事件还应当在24小时内按个例事件报告。
以及第三十二条,持有人发现或者获知其产品的群体医疗器械不良事件后,应当立即暂停生产、销售,通知使用单位停止使用相关医疗器械,同时开展调查及生产质量管理体系自查,并于7日内向所在地及不良事件发生地省、自治区、直辖市药品监督管理部门和监测机构报告。调查应当包括产品质量状况、伤害与产品的关联性、使用环节操作和流通过程的合规性等。自查应当包括采购、生产管理、质量控制、同型号同批次产品追踪等。持有人应当分析事件发生的原因,及时发布风险信息,将自查情况和所采取的控制措施报所在地及不良事件发生地省、自治区、直辖市药品监督管理部门,必要时应当召回相关医疗器械。
本内容虽然没有明确的法规要求和工作标准来确定是否需要做产品风险评价,但在《办法》第六十七条有提到过上市后研究的条款:有下列情形之一的,药品监督管理部门应当对持有人开展重点检查:
(一)未主动收集并按照时限要求报告医疗器械不良事件的;
(二)持有人上报导致或可能导致严重伤害或者死亡不良事件的报告数量与医疗机构的报告数量差距较大,提示其主体责任未落实到位的;
(三)瞒报、漏报、虚假报告的;
(四)不配合药品监督管理部门开展的医疗器械不良事件相关调查和采取的控制措施的; (五)未按照要求通过不良事件监测收集产品安全性信息,或者未按照要求开展上市后研究、再评价,无法保证产品安全有效的。
产品风险评价报告的产生和审核
视频播放地址:
根据办法第五章、第六章
第五章 风险控制
第四十八条 持有人通过医疗器械不良事件监测,发现存在可能危及人体健康和生命安全的不合理风险的医疗器械,应当根据情况采取以下风险控制措施,并报告所在地省、自治区、直辖市药品监督管理部门:
(一)停止生产、销售相关产品;
(二)通知医疗器械经营企业、使用单位暂停销售和使用;
(三)实施产品召回;
(四)发布风险信息;
(五)对生产质量管理体系进行自查,并对相关问题进行整改;
(六)修改说明书、标签、操作手册等;
(七)改进生产工艺、设计、产品技术要求等;
(八)开展医疗器械再评价;
(九)按规定进行变更注册或者备案;
(十)其他需要采取的风险控制措施。
与用械安全相关的风险及处置情况,持有人应当及时向社会公布。
第六章 再评价
第五十五条 有下列情形之一的,持有人应当主动开展再评价,并依据再评价结论,采取相应措施:
(一)根据科学研究的发展,对医疗器械的安全、有效有认识上改变的;
(二)医疗器械不良事件监测、评估结果表明医疗器械可能存在缺陷的;
(三)国家药品监督管理局规定应当开展再评价的其他情形。
第五十六条 持有人开展医疗器械再评价,应当根据产品上市后获知和掌握的产品安全有效信息、临床数据和使用经验等,对原医疗器械注册资料中的综述资料、研究资料、临床评价资料、产品风险分析资料、产品技术要求、说明书、标签等技术数据和内容进行重新评价。
第五十七条 再评价报告应当包括产品风险受益评估、社会经济效益评估、技术进展评估、拟采取的措施建议等。
第五十八条 持有人主动开展医疗器械再评价的,应当制定再评价工作方案。通过再评价确定需要采取控制措施的,应当在再评价结论形成后15日内,提交再评价报告。其中,国家药品监督管理局批准注册或者备案的医疗器械,持有人应当向国家监测机构提交;其他医疗器械的持有人应当向所在地省级监测机构提交。
持有人未按规定履行医疗器械再评价义务的,省级以上药品监督管理部门应当责令持有人开展再评价。必要时,省级以上药品监督管理部门可以直接组织开展再评价。
【文本来源:小普医械客栈】

全部 0条评论