软件可追溯性分析作为软件验证、软件确认的重要活动之一,是指追踪软件需求、软件设计、源代码、软件测试、软件风险管理之间的关系,分析已识别关系的正确性、一致性、完整性、准确性。
软件生存周期过程均需开展可追溯性分析活动,详见图2。软件需求分析阶段追溯分析软件需求与产品需求、软件需求与风险分析的关系。软件设计阶段追溯分析软件设计与软件需求、软件设计与风险控制的关系。软件编码阶段追溯分析源代码与软件设计、源代码与测试用例的关系。内部测试阶段追溯分析单元测试、集成测试、系统测试各级测试用例与软件设计,系统测试与软件需求,系统测试与风险管理的关系。用户测试阶段追溯分析用户测试与产品需求、用户测试与风险管理的关系。软件更新亦需开展与之相适宜的软件可追溯性分析活动。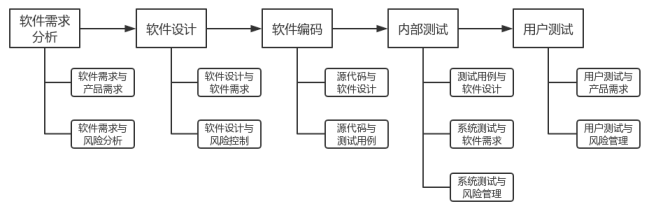
注册申请人应建立软件可追溯性分析过程,规范软件可追溯性分析相关活动要求,以保证软件验证、软件确认的质量。考虑到行业实际情况,源代码追溯分析活动追溯至软件单元(列明名称)即可。
这家伙很懒,还没有设置简介