一、 对于产品技术要求,新版标准的变化主要在于附录A产品安全特征,术语的变化,按照新版要求去规范。
1)“按对进液的防护程度分类”
GB 9706.1-2007中“5.3 用字母IP 后接上X及按 GB 4208 中外壳对有害进液防护程度来区分的特征数字(1至8)”;GB 9706.1-2020中“6.3 外壳应依据GB/T 4208 描述的对有害进液和颗粒物质的防护进行分类”,分类为IPN1N2,其中N1是用来指示对颗粒物质防护的整数或字母“X” (0至6),N2是用来指示对有害进液防护的整数或字母“X”( 0至8)。新版增加了微粒进入的防护的分类要求,增加IP代码的格式要求。
2)“电气绝缘图”
GB 9706.1-2007中分为“基本绝缘BI、双重、加强绝缘DI/RI、辅助绝缘SI”;GB 9706.1-2020中分为“操作者防护(MOOP)降低点击对非患者人员带来的风险的防护措施、患者防护(MOPP)降低电击对患者带来的风险的防护措施”。新版删除了带电部件这一术语,明确了绝缘是对电击的防护,绝缘图的修改按照新版标准修改。
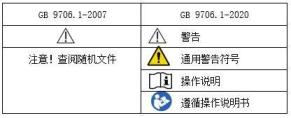
二、说明书和标签样稿
1)“标识说明”