1 回答
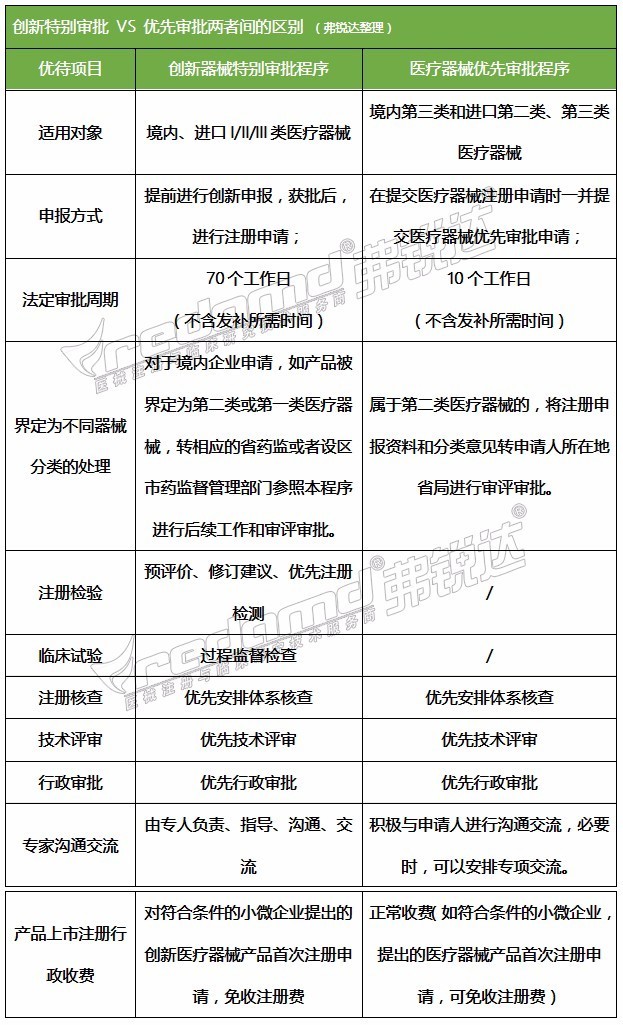
从上可以看出,两者的本质其实都是为了实现产品的快速审批获证,减少中间环节所耽误的时间,使得产品能迅速投放市场,取得产品价值。但我国的械企众多,产品繁多,而各械企的水平参差不齐,大多产品在国内并没有太多的创新独特与应急之处,很多都是借鉴前人的经验来研发或复制的,这就导致很难实现真正意义上的国内首创,走创新器械特别审批的道路是相对困难的。按照以往的创新器械的评审情况,概率约在10%~20%之间,对于大多械企业来说,是望尘莫及的。
相比医疗器械优先审批来讲,有CFDA发布的各项优先审批程序的法规,同时地方也相继出台了优先审批程序,凡是列入国家科技重大专项或国家重点研发计划的医疗器械,或者符合一些规定情形的,可以进入优先审批。其实在今年1月份CFDA就发布了2017年第1号公示:“血液透析/滤过装置”,被列入国家重点研发计划。自此首家通过医疗器械优先审批的企业诞生了,这也为其它后来者做好了榜样。