1 回答
持续葡萄糖监测系统(Continuous Glucose Monitoring System,CGMS)目前批准适用范围一般为“产品用于糖尿病成年患者(≥18岁)的组织间液葡萄糖水平的连续或定期监测。产品可提供并存储连续葡萄糖值,供用户跟踪葡萄糖浓度变化的趋势,如葡萄糖水平低于或高于预设值,产品可发出提醒。产品测量结果不作为决定和调整糖尿病患者治疗方案的依据。”国际儿童和青少年糖尿病学会(ISPAD)发布的《2022 ISPAD临床实践指南:儿童、青少年和年轻糖尿病患者的血糖目标和血糖监测》中推荐将儿童、青少年及25岁以下年轻患者纳入持续葡萄糖监测(CGM)控制目标。已上市用于成人的持续葡萄糖检测系统拟增加2-17岁儿童适用范围时,在已有成人适用范围批准的基础上,需通过临床试验路径进行临床评价。
2-17岁儿童可分为2-5岁、6-17岁2个年龄组。其中,6-17岁年龄组入组样本量应保持与成人临床试验要求一致,以静脉血糖值(使用EKF血糖检测仪或Yellow Spring Instrument(YSI)的检测结果)为对照,至少应入组60例提供1200个测量点。2-5岁年龄组儿童如考虑伦理学因素可采用指尖血测量血糖值作为对照,应入组一定样本量的受试者以保证主要评价指标满足要求。
临床试验可采用多中心的自身对照设计,主要评价指标包括:1.与参考值的20/20%的一致性,通过一致率表示;2.测量点落在Clarke误差栅格分析A+B区的比例;3.测量点落在Consensus误差栅格分析A+B区的比例;4.平均绝对相对误差值(MARD%)。
2-5岁、6-17岁各年龄组临床试验结果要求上述四项主要评价指标均应同时达到表1所列标准,方能认为产品性能符合临床应用需要,即按照共同主要终点设置。上述四项主要评价指标中有任何一项或多项未达到所列出的评价标准要求,则不认可产品性能。需注意的是,MARD%评价需先计算每位受试者水平的结果,而不能像其他指标直接计算所有测量点水平的汇总结果。
表1主要评价指标对应的评价标准及原则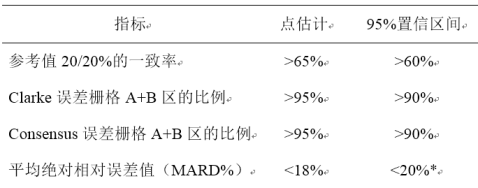
*评价95%置信区间的上限,其余指标评价下限。
上述关于持续葡萄糖监测系统临床试验设计的要求,仅针对传统持续葡萄糖检测系统,即产品用于糖尿病患者的组织间液葡萄糖水平的连续或定期监测,测量结果不作为决定和调整糖尿病患者治疗方案的依据。(中国器审-临床一部)